Um tratamento experimental único para mucopolissacaridose tipo II (síndrome de Hunter)
A REGENXBIO, líder global em terapia gênica AAV, está atualmente inscrevendo participantes em um estudo clínico de RGX-121, uma terapia gênica experimental única para o tratamento potencial da mucopolissacaridose tipo II, também conhecida como MPS II ou síndrome de Hunter. O estudo clínico, denominado Estudo CAMPSIITE™, avaliará o efeito da RGX-121 em meninos com MPS II1 neuronopática entre as idades de 4 meses e 5 anos.
Sobre a Síndrome de Hunter
O que é a Mucopolissacaridose Tipo II (MPS II)?
A MPS II, ou síndrome de Hunter, é uma condição genética rara que ocorre em aproximadamente um em cada 100.000 a 170.000 nascimentos masculinos.1
- As pessoas que vivem com MPS II têm uma mutação no gene responsável pela produção de uma enzima chamada iduronato-2-sulfatase (IDS)).1
- As células precisam dessa enzima para decompor longas cadeias de moléculas de açúcar conhecidas como glicosaminoglicanos (GAGs).1
- Se os GAGs se acumularem nas células do corpo, podem causar danos progressivos a muitos órgãos, incluindo cérebro, ouvidos, pulmões, coração, estômago, intestinos, ossos, articulações, boca e pele. 2
- Os danos decorrentes do acúmulo de GAG nas células são irreversíveis, destacando a importância do diagnóstico e tratamento precoces. 4
- Os tratamentos atualmente aprovados para a síndrome de Hunter não abordam o impacto da MPS II no cérebro. 3
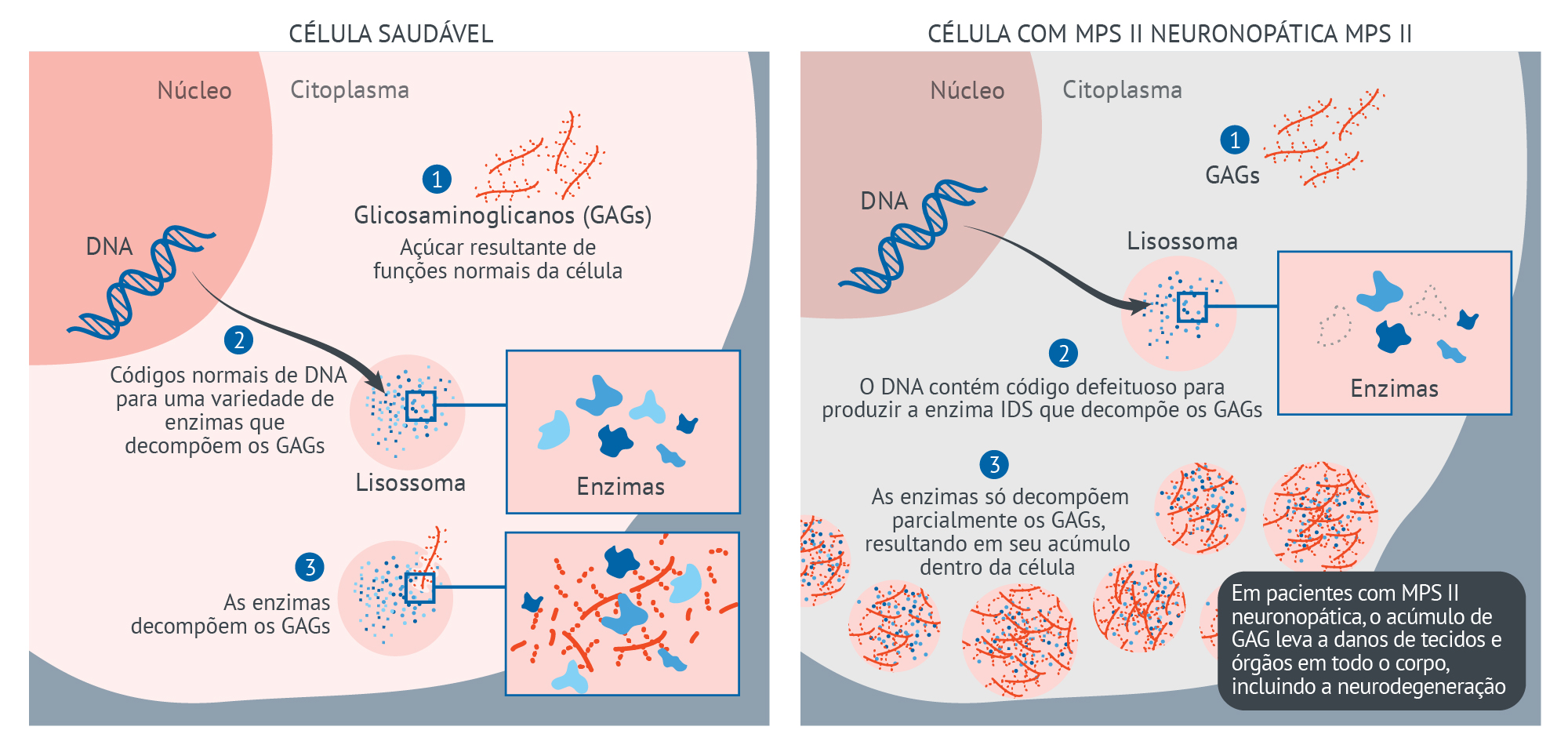
Célula Saudável versus Célula com MPS II
CÉLULA SAUDÁVEL
- Glicosaminoglicanos (GAGs): Moléculas de açúcar resultantes de funções celulares normais
- O DNA normal codifica uma variedade de enzimas que decompõem os GAGs
Enzimas (essas enzimas estão no lisossoma, não flutuando pelo citoplasma – portanto, Doenças de Depósito Lisossômico)
- As enzimas decompõem os GAGs
CÉLULA COM MPS II NEURONOPÁTICA
- O DNA contém um código defeituoso para a produção de uma enzima específica que decompõe os GAGs
Citoplasma (no lisossoma, não no citoplasma)
- As enzimas só decompõem parcialmente os GAGs, resultando em seu acúmulo dentro da célula
- Em pacientes com MPS II neuronopática, o acúmulo de GAG leva a danos nos tecidos e órgãos em todo o corpo, inclusive neurodegeneração.
Tipos de MPS II
Geralmente, há dois tipos de MPS II, que variam amplamente em termos de gravidade, taxa de progressão e idade de início.
Atenuada
Na MPS II atenuada, a doença progride lentamente, com impacto mínimo ou nenhum impacto no cérebro ou no desenvolvimento intelectual. 1
Neuronopática
Na MPS II neuronopática, também conhecida como MPS II grave, há uma taxa mais rápida de progressão da doença e impacto significativo no cérebro e no desenvolvimento intelectual. 1 A MPS II neuronopática é responsável por até 70%2 das incidências da doença. 6
Na MPS II grave, ou na forma neuronopática, uma criança pode atingir os marcos iniciais do desenvolvimento, mas a taxa de aquisição de habilidades diminui no início do desenvolvimento (geralmente 12 a 24 meses após o nascimento). Esse atraso se torna mais aparente com o tempo, com habilidades de neurodesenvolvimento (aprendizagem e compreensão, linguagem expressiva) e habilidades motoras finas movendo-se fora da faixa normal entre 24 e 29 meses. A aquisição de habilidades geralmente se estabiliza por volta dos 5 a 6 anos, com a criança em um nível de desenvolvimento semelhante a uma criança não afetada de 2 a 3 anos.1-5
As atividades de neurodesenvolvimento incluem:
- Aprendizagem
- Compreensão
- Linguagem expressiva
Sintomas
Crianças com MPS II podem apresentar uma variedade de sintomas, dependendo da idade de início e gravidade da condição:1,2,6
- Infecções de ouvido recorrentes
- Hérnia umbilical ou inguinal (uma protuberância de parte do intestino através da abertura na musculatura abdominal ou na região da virilha)
- Hidrocefalia (acúmulo de líquido no cérebro)
- Engrossamento das narinas e lábios
- Macrocefalia (cabeça maior que o normal)
- Macroglossia ( língua maior que o normal)
- Hepatoesplenomegalia (baço e fígado aumentados)
- Perda de audição
- Amígdalas aumentadas
- Voz rouca
- Distúrbios do sono
- Baixa estatura
- Articulações rígidas e movimento limitado nas articulações
- Síndrome do túnel do carpo
- Atraso no crescimento
- Aparecimento tardio dos dentes ou espaços amplos entre os dentes
- Manchas esbranquiçadas na pele
- Declínio do neurodesenvolvimento, deficiência intelectual
- Problemas comportamentais (hiperatividade, problemas de atenção, destrutividade, ausência de medo)
Recursos adicionais
Para mais informações sobre a MPS II, visite os seguintes links:
- National MPS Society (EUA) (site disponível em inglês)
- Project Alive (site disponível em inglês)
- National Organization for Rare Disorders (NORD) (site disponível em inglês)
- Casa Hunter (Brasil) (site disponível em inglês e português)
- Canadian MPS Society for Mucopolysaccharide & Related Diseases (site disponível em inglês)
- Orphanet (site disponível em tcheco, holandês, inglês, francês, alemão, italiano, polonês, português e espanhol)
Recursos adicionais
Para mais informações sobre a MPS II, visite os seguintes links:
National MPS Society (EUA) (site disponível em inglês)
Project Alive (site disponível em inglês)
National Organization for Rare Disorders (NORD) (site disponível em inglês)
Casa Hunter (Brasil) (site disponível em inglês e português)
Canadian MPS Society for Mucopolysaccharide & Related Diseases (site disponível em inglês)
Orphanet (site disponível em tcheco, holandês, inglês, francês, alemão, italiano, polonês, português e espanhol)
Referências:
- Rare Disease Database: Mucopolysaccharidosis type II. NORD – National Organization for Rare Disorders, Inc.; 2021. https://rarediseases.org/rare-diseases/mucopolysaccharidosis-type-ii-2/.
- Escolar ML, Jones SA, Shapiro EG, Horovitz DDG, Lampe C, Amartino H. Practical management of behavioral problems in mucopolysaccharidoses disorders. Mol Genet Metab. 2017;122:35-40.
- D’Avanzo F, Rigon L, Zanetti A, Tomanin R. Mucopolysaccharidosis type II: one hundred years of research, diagnosis, and treatment. Int J Mol Sci. 2020;21:1258.
- Muenzer J, Bodamer O, Burton B, et al. The role of enzyme replacement therapy in severe Hunter syndrome – an expert panel consensus. Eur J Pediatr. 2012;171:181-188.
- Escolar M, Phillips D, Cho Y, Mulatya C, Nevoret M-L, Poe M. Natural history of neurodevelopment in neuronopathic mucopolysaccharidosis type II (MPS II): Mullen Scales of Early Learning (MSEL) visual reception, expressive and receptive language and fine motor scale developmental trajectories. Presented at 2022 annual symposium of the Society for the Study of Inborn Errors of Metabolism (SSIEM), Freiburg, Germany, August 2022. Abstract SSIEM22-2814.
- Scarpa M. Mucopolysaccharidosis type II. GeneReviews® [Internet]; 2018. https://www.ncbi.nlm.nih.gov/books/NBK1274/.
Sobre a Terapia Gênica RGX-121
O que são genes e terapia gênica?1-3
Cada célula do corpo humano contém cromossomas compostos de genes. Esses genes consistem em DNA, que fornece instruções que dizem ao corpo como produzir proteínas, que são um elemento essencial para nossos organismos. O corpo humano contém milhares de genes.
A terapia gênica é um tratamento que envolve a introdução, remoção ou alteração do material genético nas células de uma pessoa. Existem várias abordagens para a terapia gênica:
Adição de genes
O fornecimento de um gene a uma pessoa, permitindo que o corpo dessa pessoa produza uma proteína funcional (às vezes também chamada de substituição de gene). A RGX-121 usa essa abordagem.
Edição de genes
A inserção, substituição ou exclusão de DNA defeituoso dentro de um gene. 2-3
Modificação de RNA
A modificação do RNA (uma molécula semelhante ao DNA que ajuda a célula a criar proteínas a partir de genes) para bloquear a produção de proteína disfuncional de um gene mutante.
O que é a Tecnologia NAV®?
As terapias gênicas da REGENXBIO estão sendo investigadas em estudos clínicos e foram projetadas para fornecer genes funcionais a células usando vetores de vírus adenoassociados (adeno-associated virus – AAV) como “veículos” de entrega. Os vetores AAV são vírus modificados que não podem aumentar seus números ou se reproduzir e não são conhecidos por causar doenças em humanos.
Todas as nossas terapias gênicas investigativas usam vetores virais de nossa plataforma proprietária de fornecimento de genes, que chamamos de plataforma tecnológica NAV®. Milhares de pacientes receberam terapias gênicas AAV derivadas da nossa plataforma tecnológica NAV.
O que é RGX-121?
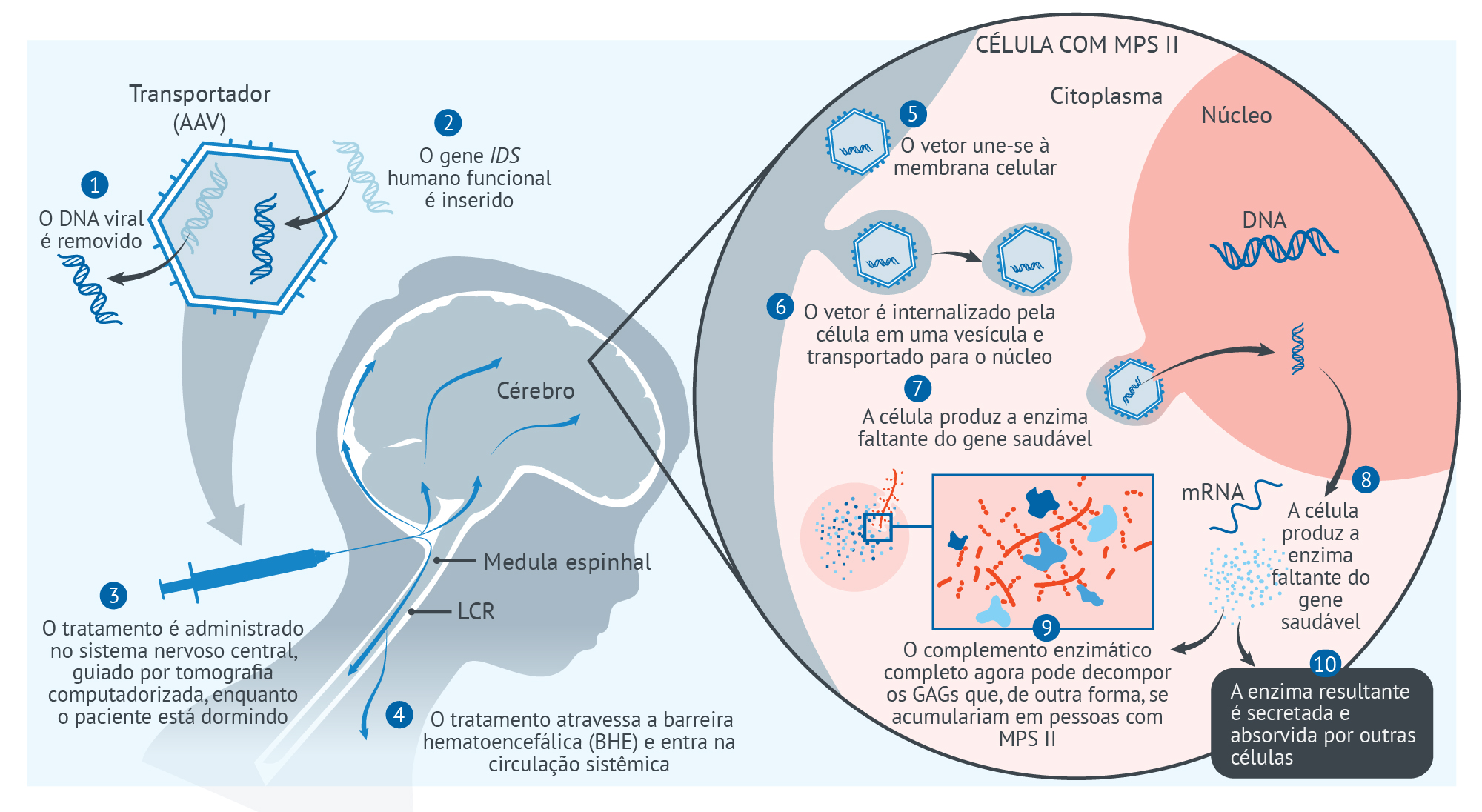
A RGX-121 é uma terapia gênica experimental única para o tratamento potencial da MPS II. Foi projetada para usar o vetor NAV® AAV9 para fornecer o gene humano da iduronato-2-sulfatase (IDS) diretamente ao fluido que envolve o cérebro, conhecido como líquido cefalorraquidiano (LCR).
- Depois que o vetor NAV® AAV9 fornece o gene IDS às células no cérebro, as células podem começar a produzir a enzima I2S necessária e podem fornecer uma fonte permanente de I2S no sistema nervoso central (SNC), que consiste no cérebro e na medula espinhal.
- A produção contínua da enzima pode prevenir o declínio do neurodesenvolvimento em crianças que recebem a terapia gênica no início da vida e pode impedir que o dano piore em crianças que recebem a terapia gênica em uma idade mais avançada.
- Ao contrário dos tratamentos atualmente disponíveis para MPS II, a RGX-121 pode atravessar a barreira hematoencefálica (BHE), uma rede protetora de vasos sanguíneos e células que separa o SNC do resto do corpo. Ao cruzar a BHE do SNC para atingir o resto do corpo, a RGX-121 pode abordar os efeitos sistêmicos (aqueles que afetam o corpo como um todo) da MPS II.4
Transportador (AAV)
- O DNA viral é removido
- O gene IDS humano funcional é inserido
- O tratamento é administrado no sistema nervoso central, guiado por tomografia computadorizada, enquanto o paciente está dormindo
- O vetor une-se à membrana celular
- O vetor é internalizado pela célula em uma vesícula e transportado
- O vetor libera o gene funcional no núcleo
- A célula produz a enzima faltante do gene saudável
- 8. O complemento enzimático completo agora pode decompor os GAGs que, de outra forma, se acumulariam em pessoas com MPS II
- A enzima resultante é secretada e absorvida por outras células
A RGX-121 recebeu as designações de Medicamento Órfão, Doença Pediátrica Rara e Fast Track da Administração de Alimentos e Medicamentos (Food and Drug Administration) dos EUA, assim como a designação Medicamento Órfão da Agência Europeia de Medicamentos (EMA).RGX-121 has received Orphan Drug Product, Rare Pediatric Disease, and Fast Track designations from the U.S. Food and Drug Administration, as well as Oprhan Drug Designation from the European Medicines Agency (EMA).
Referências
- Different approaches. American Society of Gene + Cell Therapy; 2022. https://patienteducation.asgct.org/gene-therapy-101/different-approaches.
- Petrich J, Marchese D, Jenkins C, Storey M, Blind J. Gene replacement therapy: a primer for the health-system pharmacist. sJ Pharm Pract. 2020;33(6):846-855.
- Adachi H, Hengesbach M, Yu Y-T, Morais P. From antisense RNA to RNA modification: therapeutic potential of RNA-based technologies. Biomedicines. 2021;9(5):550.
- Pukenas B, Papisov M, Buss N, et al. Intracisternal administration of AAV9 gene therapies to target the central nervous system. Presented at WORLDSymposium™ 2021 Virtual Scientific Meeting, February 9, 2021, Poster #207.
Estudo CAMPSIITE™
Visão geral do estudo clínico
Atualmente, estamos inscrevendo crianças com síndrome de Hunter neuropática (MPS II) com mais de 4 meses e menos de 5 anos no Estudo CAMPSIITE™, um estudo da RGX-121 multicêntrico, aberto e de grupo único de Fase I/II/III.
Participar do CAMPSIITE
Se seu filho foi diagnosticado com MPS II e sua família está interessada em participar do Estudo CAMPSIITE, fale com o médico que atende seu filho para MPS II ou entre em contato com um dos centros do estudo. O CAMPSIITE é um estudo clínico global, que deverá incluir centros nos EUA, Brasil e Canadá.
Reunião inicial com o médico do estudo
Os pais de crianças que possam ser elegíveis precisarão se reunir com um médico do estudo para revisar os detalhes do estudo e o processo de consentimento livre e esclarecido.
Determinação da elegibilidade
O médico do estudo e a equipe falarão sobre a saúde de seu filho, informações básicas sobre o estudo e possivelmente solicitarão os prontuários médicos.
Se elegível e se você decidir incluir seu filho
Se parecer que seu filho pode se qualificar, a equipe do estudo pode programar uma visita de triagem inicial para começar a determinar a elegibilidade e revisar o Termo de Consentimento Livre e Esclarecido com você em detalhes. O processo de determinação da elegibilidade pode levar algumas semanas.
Duração do estudo principal
Se seu filho se qualificar e você decidir incluí-lo no estudo, a participação na parte principal do estudo durará cerca de 2 anos. Durante esse período, seu filho visitará a clínica várias vezes por ano para vários exames e avaliações.
Acompanhamento de longo prazo
Ao final do estudo principal, seu filho será incentivado a ser incluído em um estudo de acompanhamento de longo prazo, que visa compreender a segurança e eficácia de longo prazo da RGX-121.
Acesse ClinicalTrials.gov, usando o identificador NCT03566043 para obter mais informações sobre este estudo, inclusive critérios de elegibilidade.
Encontre um centro do estudo perto de você!
Espera-se que o Estudo CAMPSIITE™ inclua centros nos EUA, Brasil e Canadá.
Fale conosco
Se quiser entrar em contato com um membro de nossa equipe de apoio ao paciente, envie um e-mail para MPSII@regenxbio.com.
Dúvidas específicas sobre o estudo
Para dúvidas específicas sobre o estudo, como elegibilidade, entre em contato com um centro do estudo. Informações de contato dos centros de estudo podem ser encontradas em ClinicalTrials.gov (identificador n.º NCT03566043).
Somente profissionais da saúde
Se for um profissional da saúde e quiser obter mais informações sobre nossos estudos para pacientes com MPS II, entre em contato conosco pelo e-mail medinfo@regenxbio.com.