Traitement expérimental à dose unique de la mucopolysaccharidose de type II (syndrome de Hunter)
REGENXBIO, un chef de file mondial de la thérapie génique AAV, recrute actuellement des participants à un essai clinique visant à évaluer RGX-121, une thérapie génique expérimentale à dose unique pour le traitement potentiel de la mucopolysaccharidose de type II, également connue sous le nom de MPS II ou syndrome de Hunter. L’essai clinique, appelé « Étude CAMPSIITE™ », évaluera l’effet de RGX-121 chez des garçons atteints de MPS II1 neuronopathique âgés de 4 mois à 5 ans.
À propos du syndrome de Hunter
Qu’est-ce que la mucopolysaccharidose de type II (MPS II)?
La MPS II, ou syndrome de Hunter, est une maladie génétique rare qui survient dans environ une naissance masculine sur 100 000 à 170 000.1
- Les personnes atteintes de MPS II présentent une mutation du gène responsable de la fabrication d’une enzyme appelée iduronate-2-sulfatase (IDS). 1
- Les cellules ont besoin de cette enzyme pour décomposer de longues chaînes de molécules de sucre appelées glycosaminoglycanes (GAG). 1
- Si les GAG s’accumulent dans les cellules du corps, ils peuvent causer des dommages progressifs à de nombreux organes, y compris le cerveau, les oreilles, les poumons, le cœur, l’estomac, les intestins, les os, les articulations, la bouche et la peau. 2
- Les dommages résultant de l’accumulation de GAG dans les cellules sont irréversibles, ce qui souligne l’importance d’un diagnostic et d’un traitement précoces. 4
- Les traitements approuvés actuels pour le syndrome de Hunter ne traitent pas compte des effets de la MPS II sur le cerveau. 3
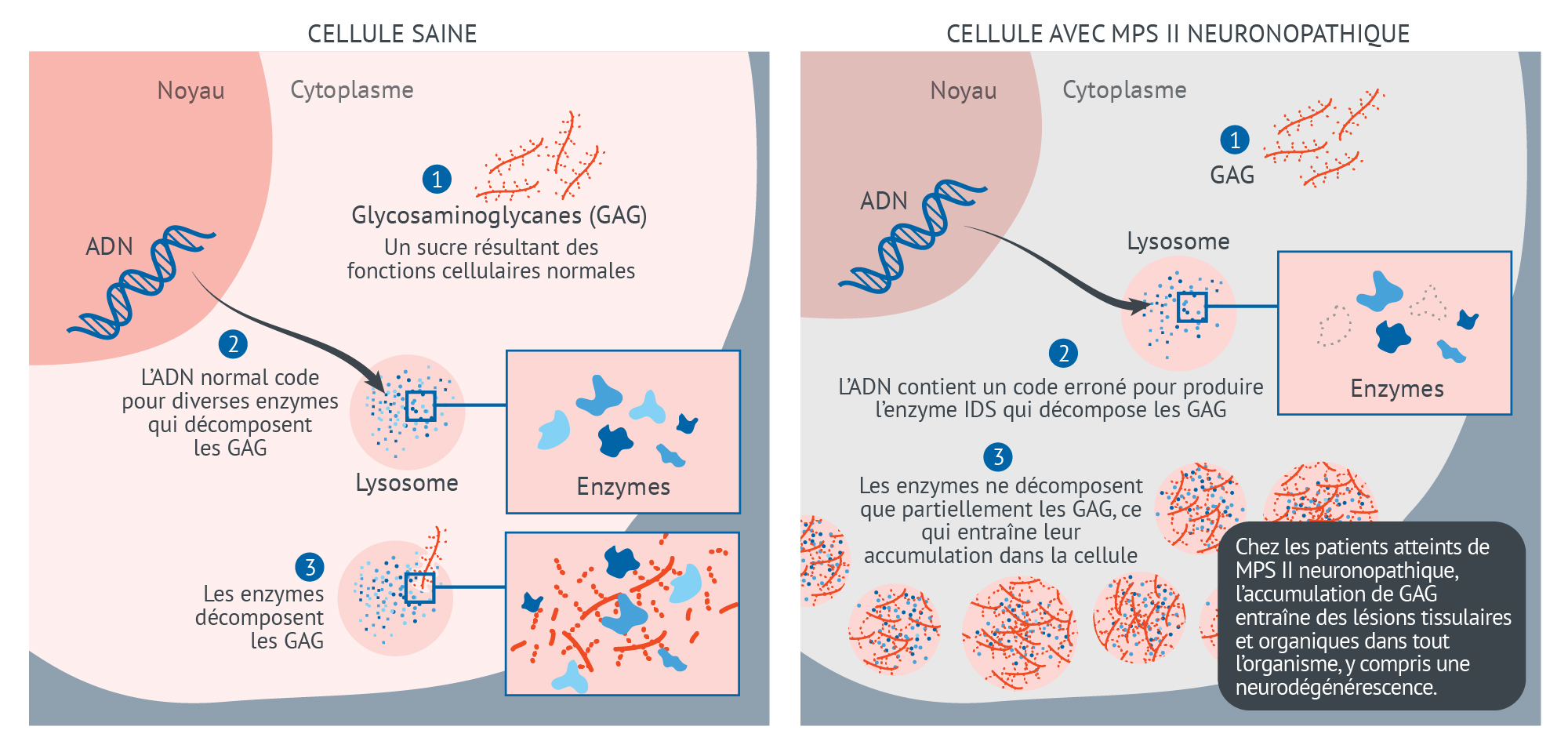
Cellule saine vs Cellule avec MPS II
CELLULE SAINE
- Glycosaminoglycanes (GAG) Molécules de sucre résultant de fonctions cellulaires normales
- L’ADN normal code pour diverses enzymes qui décomposent les GAG
Ces enzymes sont dans le lysosome, et non en suspension dans le cytoplasme – d’où le trouble de stockage lysosomal
- Les enzymes décomposent les GAG
CELLULE AVEC MPS II NEURONOPATHIQUE
- L’ADN contient un code erroné pour la production d’une enzyme spécifique qui décompose les GAG
Cytoplasme (dans le lysosome plutôt que dans le cytoplasme)
- Les enzymes ne décomposent que partiellement les GAG, ce qui entraîne leur accumulation dans la cellule
- Chez les patients atteints de MPS II neuronopathique, l’accumulation de GAG entraîne des lésions tissulaires et organiques dans tout l’organisme, y compris une neurodégénérescence
Types de MPS II
En général, il existe deux types de MPS II, qui varient considérablement en termes de gravité, de taux de progression et d’âge d’apparition.
Atténuée
Dans la MPS II atténuée, la maladie progresse lentement, avec des effets minimes ou nuls sur le cerveau ou le développement intellectuel1.
Neuronopathique
Dans la MPS II neuronopathique, également connue sous le nom de MPS II grave, la progression de la maladie est plus rapide et a des effets significatifs sur le cerveau, ainsi que sur le développement intellectuel.1 La MPS II neuronopathique représente jusqu’à 70 % 2 des cas de la maladie 6.
Dans la MPS II grave, ou la forme neuronopathique, l’enfant peut atteindre les premiers stades de développement, mais le rythme d’acquisition des compétences ralentit tôt dans le développement (généralement entre 12 et 24 mois après la naissance). Ce retard devient plus apparent avec le temps; les capacités neurodéveloppementales (apprentissage et compréhension, langage expressif) et la motricité fine se situant en dehors de la plage normale entre 24 et 29 mois. L’acquisition des compétences atteint généralement un plateau vers l’âge de 5 à 6 ans, l’enfant fonctionnant alors à un niveau de développement similaire à celui d’un enfant de 2 à 3 ans non atteint de la maladie1-5.
Les activités neurodéveloppementales comprennent :
- Apprentissage
- Compréhension
- Langage expressif
Symptômes
Les enfants atteints de MPS II peuvent présenter des symptômes divers, en fonction de l’âge d’apparition et de la gravité de la maladie: 1,2,6
- Infections récurrentes de l’oreille
- Hernie ombilicale ou inguinale (renflement d’une partie de l’intestin à travers l’ouverture des muscles abdominaux ou dans la région de l’aine)
- Hydrocéphalie (accumulation de liquide dans le cerveau)
- Épaississement des narines et des lèvres
- Macrocéphalie (tête plus grosse que la normale)
- Macroglossie (langue plus grosse que la normale)
- Hépatosplénomégalie (hypertrophie de la rate et du foie)
- Perte auditive
- Hypertrophie des amygdales
- Voix rauque
- Troubles du sommeil
- Petite taille
- Raideur dans les articulations et limitation des mouvements articulaires
- Syndrome du canal carpien
- Retard de croissance
- Apparition tardive des dents ou espaces importants entre les dents
- Excroissances blanches sur la peau
- Déclin du développement neurologique, déficience intellectuelle
- Problèmes de comportement (hyperactivité, problèmes d’attention, destructivité, absence de crainte)
Ressources additionnelles
Pour obtenir plus d’informations au sujet de la MPS II, consultez les liens suivants:
- National MPS Society (U.S.) (anglais)
- Project Alive (anglais)
- National Organization for Rare Disorders (NORD) (anglais)
- Casa Hunter (Brésil) (anglais, portugais)
- Canadian MPS Society for Mucopolysaccharide & Related Diseases (anglais)
- Orphanet (tchèque, néerlandais, anglais, français, allemand, italien, polonais, portugais, espagnol)
Ressources additionnelles
Pour obtenir plus d’informations au sujet de la MPS II, consultez les liens suivants:
Références:
- Rare Disease Database: Mucopolysaccharidosis type II. NORD – National Organization for Rare Disorders, Inc.; 2021. https://rarediseases.org/rare-diseases/mucopolysaccharidosis-type-ii-2/.
- Escolar ML, Jones SA, Shapiro EG, Horovitz DDG, Lampe C, Amartino H. Practical management of behavioral problems in mucopolysaccharidoses disorders. Mol Genet Metab. 2017;122:35-40.
- D’Avanzo F, Rigon L, Zanetti A, Tomanin R. Mucopolysaccharidosis type II: one hundred years of research, diagnosis, and treatment. Int J Mol Sci. 2020;21:1258.
- Muenzer J, Bodamer O, Burton B, et al. The role of enzyme replacement therapy in severe Hunter syndrome – an expert panel consensus. Eur J Pediatr. 2012;171:181-188.
- Escolar M, Phillips D, Cho Y, Mulatya C, Nevoret M-L, Poe M. Natural history of neurodevelopment in neuronopathic mucopolysaccharidosis type II (MPS II): Mullen Scales of Early Learning (MSEL) visual reception, expressive and receptive language and fine motor scale developmental trajectories. Présenté lors du symposium annuel 2022 de la Society for the Study of Inborn Errors of Metabolism (SSIEM), Fribourg, Allemagne, août 2022. Résumé SSIEM22-2814.
- Scarpa M. Mucopolysaccharidosis type II. GeneReviews® [Internet]; 2018. https://www.ncbi.nlm.nih.gov/books/NBK1274/.
À propos de la thérapie génique RGX-121
Que sont les gènes et la thérapie génique?1-3
Chaque cellule du corps humain contient des chromosomes constitués de gènes. Ces gènes sont constitués d’ADN, qui fournit des instructions indiquant à l’organisme comment fabriquer des protéines, qui constituent des éléments essentiels de notre corps. Le corps humain contient des milliers de gènes.
La thérapie génique est un traitement qui implique l’introduction, l’élimination ou la modification de matériel génétique dans les cellules d’une personne. Il existe plusieurs approches en matière de thérapie génique :
Addition de gène
L’ajout d’un gène à une personne, permettant au corps de cette personne de produire une protéine fonctionnelle (aussi parfois appelé remplacement de gène). RGX-121 utilise cette approche.
Édition génétique
L’insertion, le remplacement ou la suppression d’ADN défectueux dans un gène.2-3
Modification de l’ARN
La modification de l’ARN (une molécule semblable à l’ADN qui aide la cellule à créer des protéines à partir des gènes) dans le but de bloquer la production d’une protéine dysfonctionnelle provenant d’un gène muté.
Qu’est-ce que la technologie NAV®?
Les thérapies géniques de REGENXBIO font l’objet d’essais cliniques et sont conçues pour délivrer des gènes fonctionnels aux cellules à l’aide de vecteurs viraux adéno-associés (AAV) comme « véhicules » d’administration. Les vecteurs AAV sont des virus modifiés qui ne peuvent pas augmenter leur nombre ni se reproduire, et qui ne sont pas connus pour provoquer des maladies chez l’homme.
Nos thérapies géniques expérimentales utilisent toutes des vecteurs viraux issus de notre plateforme exclusive d’administration de gènes, que nous appelons la plateforme technologique NAV®. Des milliers de patients ont reçu des thérapies géniques AAV dérivées de notre plateforme technologique NAV.
Qu’est-ce que RGX-121?
RGX-121 est une thérapie génique expérimentale à dose unique destinée au traitement potentiel de la MPS II. Elle est conçue pour utiliser le vecteur NAV® AAV9, dans le but de délivrer le gène humain de l’iduronate-2-sulfatase (IDS) directement dans le liquide entourant le cerveau, appelé liquide céphalo-rachidien (LCR).
- Lorsque le vecteur NAV® AAV9 transmet le gène IDS aux cellules du cerveau, celles-ci peuvent commencer à produire l’enzyme I2S nécessaire et pourraient constituer une source permanente d’I2S dans le système nerveux central (SNC), qui comprend le cerveau et la moelle épinière.
- Une production continue de l’enzyme pourrait prévenir le déclin du développement neurologique chez les enfants qui reçoivent la thérapie génique en début de vie, et pourrait empêcher l’aggravation des dommages chez les enfants qui reçoivent la thérapie génique à un âge plus avancé.
- Contrairement aux traitements actuellement disponibles pour la MPS II, RGX-121 peut traverser la barrière hémato-encéphalique (BHE), un réseau protecteur de vaisseaux sanguins et de cellules qui sépare le SNC du reste du corps. En traversant la BHE à partir du SNC pour atteindre le reste de l’organisme, RGX-121 pourrait s’attaquer aux effets systémiques (ceux qui touchent l’organisme dans son ensemble) de la MPS II4.
Transporteur (vecteur viral adéno-associé, AAV)
- L’ADN viral est éliminé
- Un gène IDS humain fonctionnel est inséré
- Le traitement est administré dans le système nerveux central, guidé par TDM pendant que le patient est endormi.
- Le vecteur se lie à la membrane cellulaire
- Le vecteur est internalisé par la cellule dans une vésicule (un petit sac liquide) et transporté jusqu’au noyau
- Le vecteur libère le gène fonctionnel dans le noyau
- La cellule produit l’enzyme manquante à partir d’un gène sain
- Le complément enzymatique complet peut maintenant décomposer les GAG qui s’accumuleraient autrement chez les personnes atteintes de MPS II
- L’enzyme qui en résulte est sécrétée et absorbée par d’autres cellules.
RGX-121 a reçu les désignations de médicament orphelin, de maladie pédiatrique rare et le statut de « désignation accélérée » de la Food and Drug Administration des États-Unis, ainsi que la désignation de médicament orphelin de l’Agence européenne des médicaments (European Medicines Agency, EMA).
Références
- Different approaches. American Society of Gene + Cell Therapy; 2022. https://patienteducation.asgct.org/gene-therapy-101/different-approaches.
- Petrich J, Marchese D, Jenkins C, Storey M, Blind J. Gene replacement therapy: a primer for the health-system pharmacist. sJ Pharm Pract. 2020;33(6):846-855.
- Adachi H, Hengesbach M, Yu Y-T, Morais P. From antisense RNA to RNA modification: therapeutic potential of RNA-based technologies. Biomedicines. 2021;9(5):550.
- Pukenas B, Papisov M, Buss N, et al. Intracisternal administration of AAV9 gene therapies to target the central nervous system. Présenté lors de la réunion scientifique virtuelle WORLDSymposium™ 2021, le 9 février 2021, affiche #207.
Étude CAMPSIITE™
Aperçu de l’essai
Nous recrutons actuellement des enfants atteints du syndrome neuronopathique de Hunter (MPS II) âgés de plus de 4 mois et de moins de 5 ans, dans le cadre de l’étude CAMPSIITE™, une étude de phase I/II/III, multicentrique, ouverte et à groupe unique visant à évaluer RGX-121.
Participer à CAMPSIITE
Si votre enfant a reçu un diagnostic de MPS II et que votre famille est intéressée à participer à l’étude CAMPSIITE, veuillez en discuter avec le médecin qui traite votre enfant pour la MPS II, ou communiquez avec l’un des emplacements de l’étude. CAMPSIITE est un essai mondial qui devrait inclure des centres aux États-Unis, au Brésil et au Canada.
Première rencontre avec le médecin de l’étude
Les parents des enfants susceptibles d’être admissibles devront consulter un médecin de l’étude pour passer en revue les détails de l’étude et le processus de consentement éclairé.
Détermination de l’admissibilité
Le médecin de l’étude et l’équipe de l’étude discuteront de la santé de votre enfant, des renseignements de base concernant l’étude et demanderont éventuellement des dossiers médicaux.
En cas d’admissibilité et que vous décidez d’inscrire votre enfant
S’il s’avère que votre enfant est admissible, l’équipe de l’étude peut organiser une visite de sélection initiale pour commencer à déterminer l’admissibilité et examiner en détail le formulaire de consentement éclairé avec vous. Le processus de détermination de l’admissibilité peut prendre quelques semaines.
Durée de l'étude principale
Si votre enfant remplit les conditions requises et vous décidez de l’inscrire à l’étude, la participation à la partie principale de l’étude durera environ 2 ans. Au cours de cette période, votre enfant se rendra à la clinique plusieurs fois par an pour des tests et évaluations divers.
Suivi à long terme
À la fin de l’étude principale, votre enfant sera encouragé à s’inscrire à une étude de suivi à long terme, qui vise à comprendre l’innocuité et l’efficacité à long terme de RGX-121.
Consultez le site ClinicalTrials.gov en utilisant l’identifiant NCT03566043 pour obtenir plus de renseignements au sujet de cette étude, y compris les critères d’admissibilité.
Trouvez un centre d’étude près de chez vous!
L’étude CAMPSIITE™ devrait inclure des centres aux États-Unis, au Brésil et au Canada.
Nous Contacter
Si vous souhaitez communiquer avec un membre de notre équipe de défense des patients, vous pouvez nous envoyer un courriel à: MPSII@regenxbio.com.
Questions propres à l’étude
Pour les questions propres à l’étude, telles que l’admissibilité, veuillez communiquer avec un centre d’étude. Les coordonnées des centres d’étude sont disponibles sur ClinicalTrials.gov (identifiant no NCT03566043).
Prestataires de soins de santé
Si vous êtes un professionnel de la santé et que vous souhaitez obtenir plus de renseignements sur nos études pour les patients atteints de MPS II, veuillez communiquer avec nous via l’adresse courriel suivante: medinfo@regenxbio.com.